|
|
 |
1、申報注冊的產品已經列入《總局關于發布醫療器械分類目錄的公告》(2017年第104號)的附件《醫療器械分類目錄》,且管理類別為第二類。(注:對新研制的尚未列入分類目錄的醫療器械,申請人可以直接向國家食品藥品監督管理總局申請第三類醫療器械產品注冊,也可以依據分類規則判斷產品類別并向國家食品藥品監督管理總局申請類別確認后,申請產品注冊或者辦理產品備案。)
2、申請人應當是在廣東省轄區范圍依法進行登記的企業(醫療器械注冊人制度試點申請人要求另行規定)。
3、申請人建立與產品研制、生產有關的質量管理體系,并保持有效運行。申請注冊時樣品不得委托其他企業生產,按照創新醫療器械特別審批程序審批的或符合醫療器械注冊人制度試點要求的產品除外。
4、辦理醫療器械注冊事務的人員應當具有相應的專業知識,熟悉醫療器械注冊或者備案管理的法律、法規、規章和技術要求,如:《醫療器械監督管理條例》、《醫療器械注冊管理辦法》、《醫療器械分類規則》、《關于進一步做好醫療器械產品分類界定工作的通知》、《關于發布醫療器械產品技術要求編寫指導原則的通告》、《醫療器械臨床試驗規定》、《醫療器械臨床評價技術指導原則》、《醫療器械說明書和標簽管理規定》、食品藥品監管總局關于實施《醫療器械注冊管理辦法》和《體外診斷試劑注冊管理辦法》有關事項的通知、《關于公布醫療器械注冊申報資料要求和批準證明文件格式的公告》等。
5、申請人申請注冊,應當遵循醫療器械安全有效基本要求,保證研制過程規范,所有數據真實、完整和可溯源。
6、申請注冊的資料應當使用中文。根據外文資料翻譯的,應當同時提供原文。引用未公開發表的文獻資料時,應當提供資料所有者許可使用的證明文件。申請人對資料的真實性負責。
7、納入廣東省醫療器械注冊人制度試點的注冊申請人還應同時符合以下條件:
(1)住所位于廣州、深圳、珠海市轄區范圍內,可以是企業、研發機構和科研人員
(2)委托在廣東省行政區域內依法設立的企業生產本產品;
(3)應當配備專職的法規事務、質量管理、上市后事務等相關人員,以上人員應具有相應的專業背景和工作經驗,并不得相互兼職;
(4)具備醫療器械全生命周期管理能力,有對質量管理體系進行評估、審核和監督的人員和條件;
(5)具備承擔醫療器械質量安全責任的能力,確保研制過程規范,所有數據真實、完整、可追溯。
注:納稅信用A級納稅人、安全生產領域守信生產經營單位及其有關人員、海關高級認證企業,在辦理第二類醫療器械產品注冊時,可參照《廣東省藥品監督管理局第二類醫療器械優先審批程序》辦理。
|
1、醫療器械注冊申請表 2、證明性文件 3、醫療器械安全有效基本要求清單 4、綜述資料 5、研究資料 6、生產制造信息 |
7、臨床評價資料 8、產品風險分析資料 9、產品技術要求 10、產品注冊檢驗報告 11、產品說明書和最小銷售單元的標簽樣稿 12、 符合性聲明 |
|
名稱 |
說明 |
時限 |
|
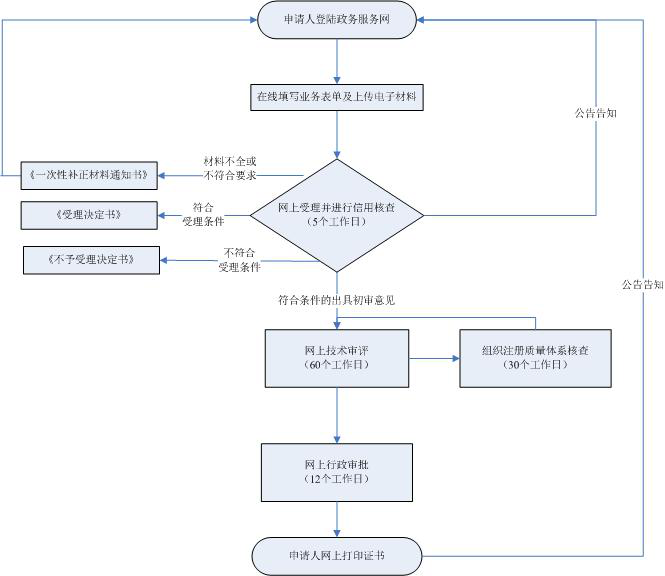
承諾辦結時限 |
受理注冊申請的藥品監督管理部門應當在技術審評結束后12個工作日內作出決定... |
12(工作日) |
|
法定辦結時限 |
受理注冊申請的藥品監督管理部門應當在技術審評結束后20個工作日內作出決定... |
20(工作日) |
| 到現場次數 |
|
0次 |